Periyodik Sistem
Periyodik Tablonun Tarihçesi
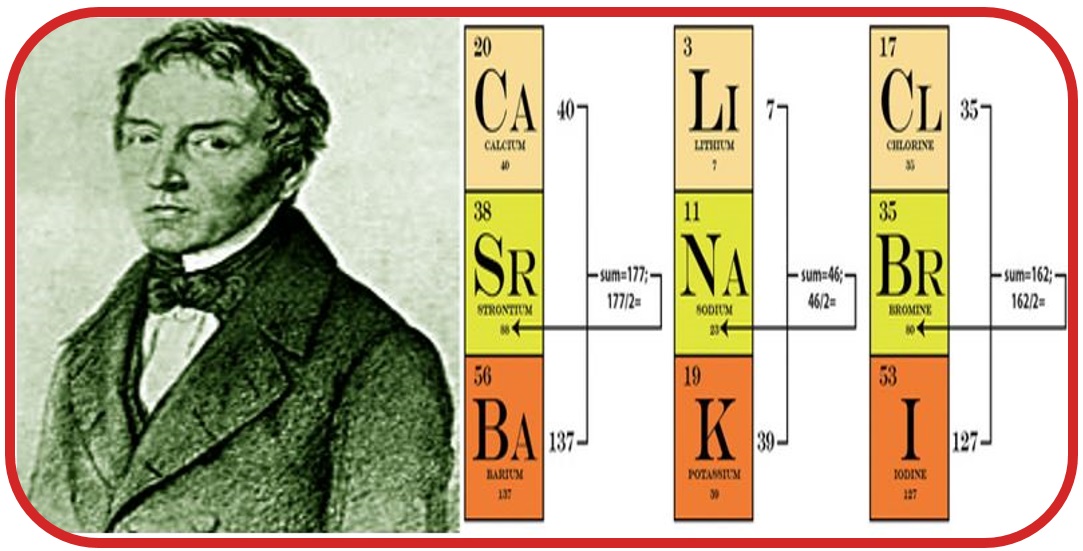
Wolfgang Döbereiner: Periyodik tabloyu benzer özellikler gösteren üçerli gruplar oluşturarak yapmıştır. Periyodik tablo ile ilgili ilk çalışmayı yapmıştır.
Alexandre Beguyer de Chancourtois: Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak sıralayarak oluşturmuştur.
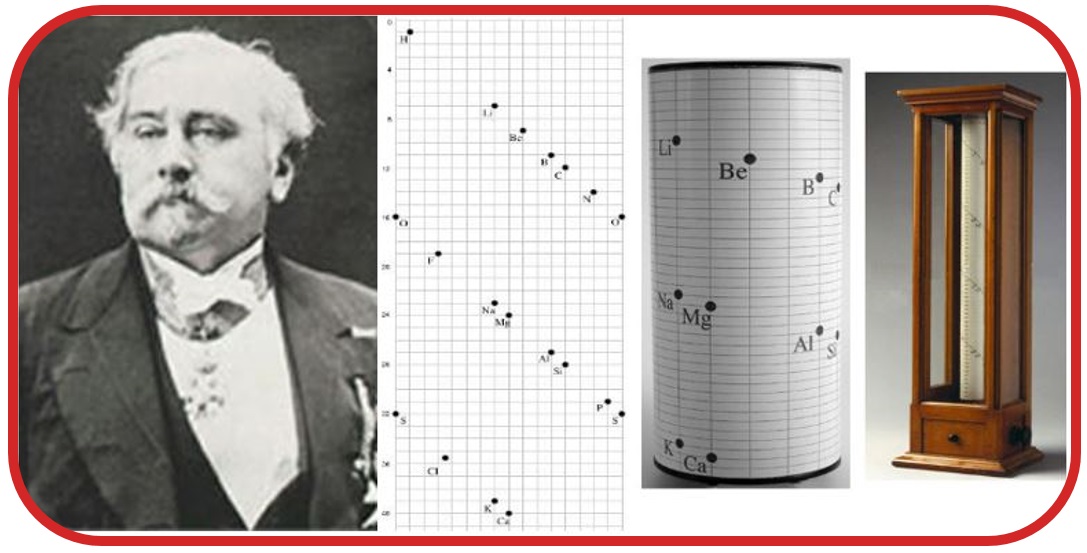
John Newlands: Elementleri atom ağırlıklarına göre sıraladı ve benzer özellik gösterenleri gruplara ayırarak tabloyu oluşturdu. Oluşturduğu tabloyu müzik notalarına benzetmiştir.

Dimitri Ivanovic Mendeleyev – Lothar Meyer: Mendeleyev elementleri artan atom ağırlıklarına göre sıralarken, Meyer benzer fiziksel özelliklerine göre sınıflandırmıştır. Mendeleyev günümüzdeki periyodik cetvelin temellerini atmıştır.

Henry Moseley: Elementleri atom numaralarına(proton sayısı) göre sınıflandırarak periyodik sistemi düzenledi.
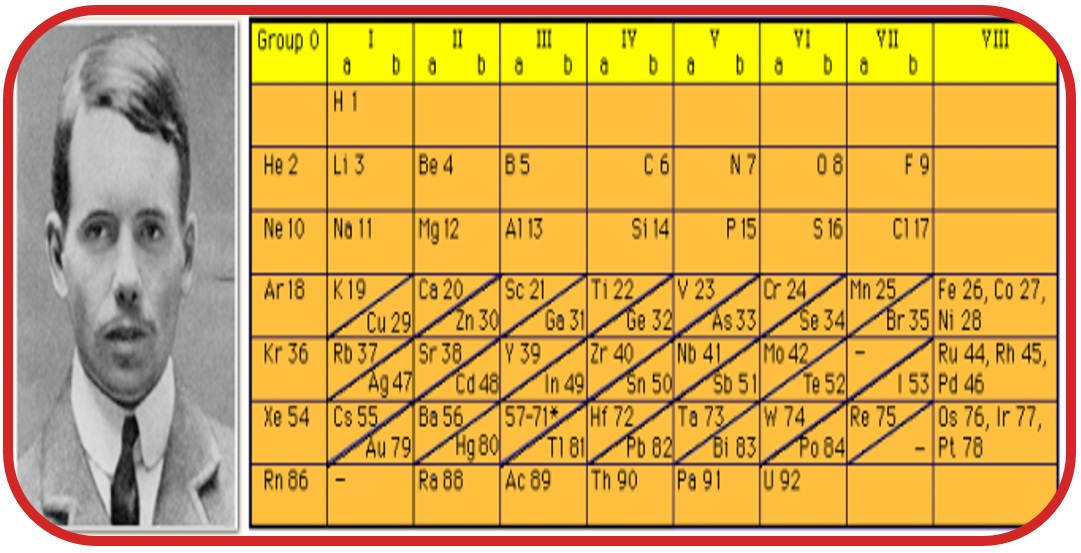
Glenn Seaborg: En alttaki iki sırayı ekleyerek (lantanit-aktinit) periyodik cetvele son halini vermiştir.
Periyodik Sistem
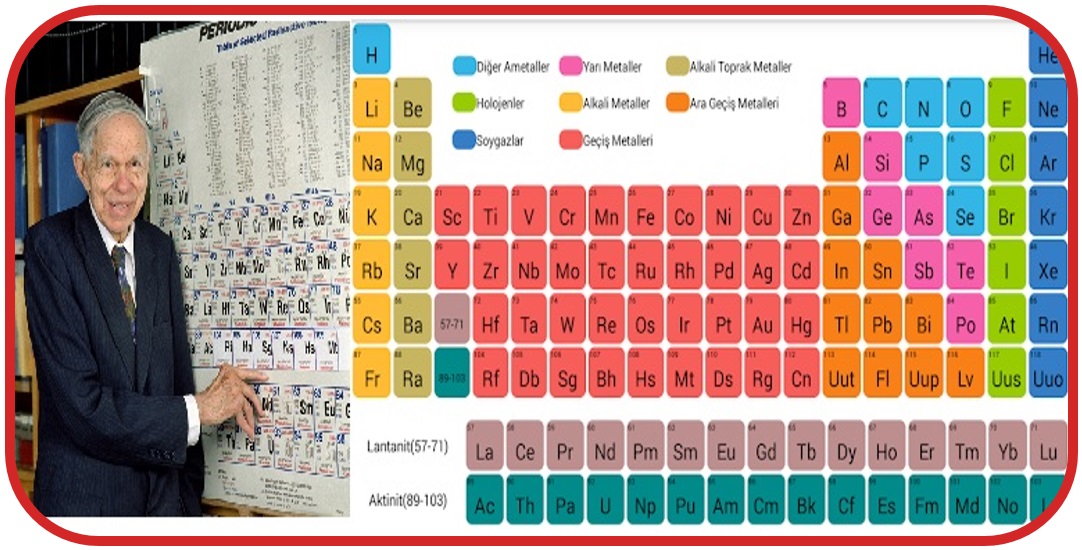
Elementlerin belirli bir düzene göre sıralanıp sınıflandırıldığı, element atomları ile ilgili bilgiler içeren çizelgeye periyodik sistem denir.
Periyodik Cetvelin Özellikleri
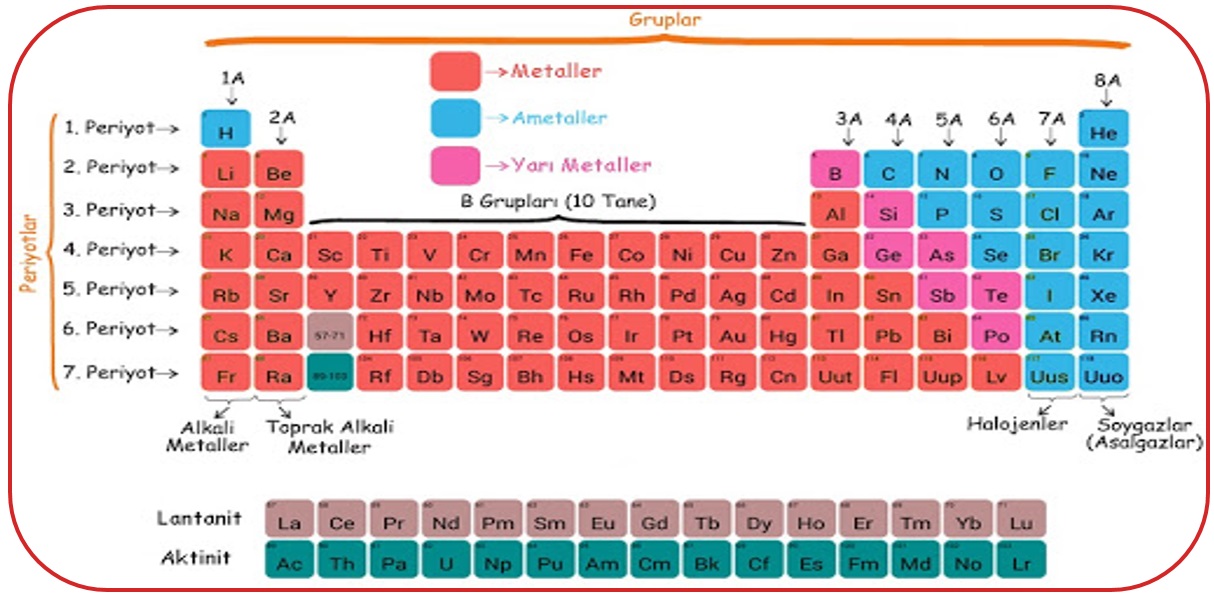
- Periyodik tabloda 7 tane periyot, 18 tane grup vardır.
- Periyodik tabloda yatay sıralara periyot, dikey sıralara grup
- Gruplardan 8 tanesi A grubu, 10 tanesi B grubudur.
- Aynı grupta bulunan elementler birçok yönden benzer özelikler gösterir.
- Tablonun sol tarafında metaller, sağ tarafında ise ametaller vardır.
- Elementin son yörüngesindeki elektron sayısına değerlik elektron sayısı denir. Değerlik elektron sayısı bize grup numarasını verir.
- Elementin katman sayısı bize periyot numarasını verir.
- Periyodik cetvelde bazı grupların özel isimleri;
- 1A Grubu – Alkali metaller,
- 2A Grubu – Toprak alkali metaller,
- 7A Grubu – Halojenler,
- 8A Grubu – Soygazlar(Asal gazlar) şeklindedir.
- Periyodik cetvel; metal, ametal ve yarı metal olmak üzere üç sınıfa ayrılır.
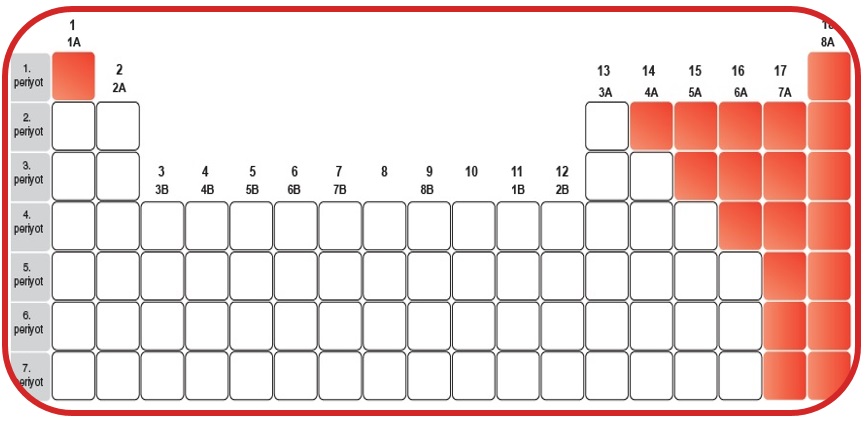
Metaller
- Periyodik tablonun sol tarafında bulunurlar. (Hidrojen hariç)
- Parlak renge sahiptirler.
- Isı ve elektriği iyi iletirler.
- Civa hariç hepsi oda sıcaklığında katı halde bulunurlar.
- Elektron vermeye yatkındırlar.
- Tel ve levha haline gelebilirler, işlenebilirler.
- Metallerle karışım oluştururlar. (alaşım)
- Ametallerle elektron alış-verişi yaparak iyonik bağlı bileşik oluştururlar.
- Erime ve kaynama noktaları yüksektir.
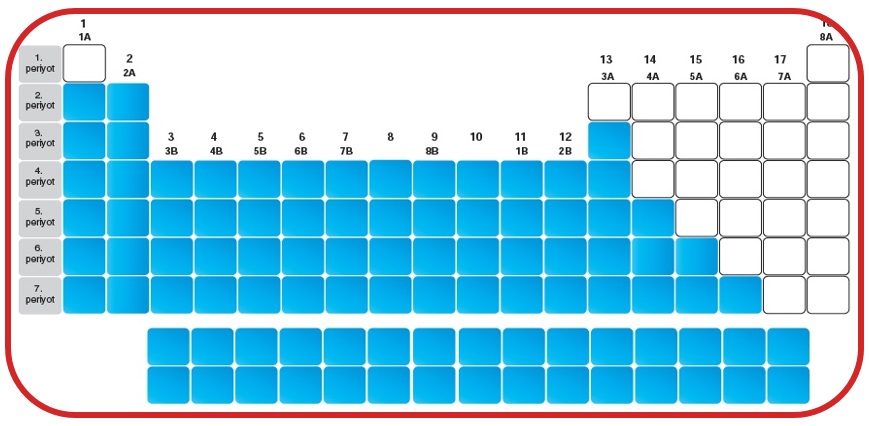
Ametaller
- Periyodik tablonun sağ tarafında bulunurlar.
- Mat renge sahiptirler.
- Isı ve elektriği iyi iletmezler.
- Oda sıcaklığında katı, sıvı ve gaz halde bulunabilirler.
- Elektron almaya yatkındırlar.
- Kırılgandırlar. Tel ve levha haline gelemezler.
- Metallerle elektron alış-verişi yaparak iyonik bağlı bileşik oluştururlar.
- Ametallerle elektron ortaklaşa kullanımı ile kovalent bağlı bileşik oluştururlar.
- Erime ve kaynama noktaları metallere göre düşüktür.
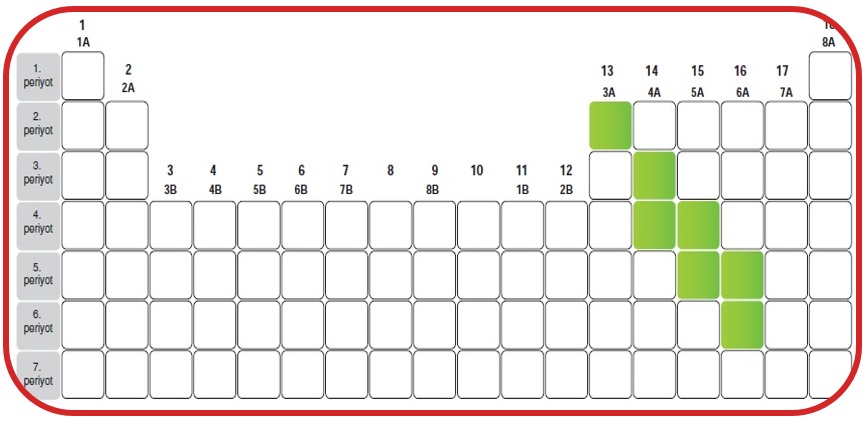
Yarı Metaller
- Görünüşleri parlak veya mat olabilir.
- Tel ve levha haline getirilebilirler.
- Elektriği ve ısıyı metallere göre daha az iletirler.
- Elektronik devrelerde ve optik malzemelerin yapımında kullanılır.
- Oda sıcaklığında katı halde bulunurlar.
- Fiziksel özellikleri metallere benzerler.
- Kimyasal özellikler ametallere benzerler.
- Bor, silisyum, germanyum, arsenik, tellür ve polonyum yarı metallere örnektir.

Soygazlar
- Periyodik tablonun en sağında bulunur.
- Oda sıcaklığında gaz haldedirler.
- Kararlı bir yapıda oldukları için elektron alıp vermezler. Diğer elementler ile bileşik oluşturmazlar.
- 8A gurubunda yer alırlar.
- Tek atomlu, atomik yapıdadırlar.
- Son katmanlarında maksimum sayıda elektron vardır.
- Helyum, Neon, Argon soygazlara örnektir.